非洲猪瘟(African swine fever, ASF)是由非洲猪瘟病毒(African swine fever virus, ASFV)引起的猪的致命传染病。目前,该疾病被列为必须向世界动物卫生组织(WOAH)报告的法定报告疾病。自非洲猪瘟爆发以来,全球养猪业的经济损失难以估量。在当前大流行期间,控制和根除非洲猪瘟至关重要。疫苗接种是预防和控制非洲猪瘟流行的最佳策略,但由于非洲猪瘟灭活疫苗免疫保护能力较差,且体外高效复制的细胞系不足,因此仍需探索具有高免疫保护潜力的非洲猪瘟疫苗。了解疾病演变过程、病毒传播途径和疫苗设计突破点将有助于非洲猪瘟疫苗的开发。本文综述了近年来非洲猪瘟在流行传播、病毒突变、疫苗研制等方面的最新进展和突破,并对未来发展方向和趋势进行了展望。1 .介绍
非洲猪瘟(African swine fever, ASF)是一种由非洲猪瘟病毒(African swine fever virus, ASFV)引起的高度传染性疾病,猪是唯一的天然宿主。ASFV是唯一感染家猪、野猪和钝边蜱的大型双链DNA病毒。该病毒呈二十面体对称,直径为200nm,呈同心圆结构。此外,ASFV基因组包含不同数量的开放阅读框(ORF),从160到175不等,其中约125个保守的ORF编码50多种功能蛋白。非洲猪瘟的临床症状分为急性型、亚急性型和慢性型。急性型非洲猪瘟起病快、病程短,表现为高热、食欲不振、发绀、内出血严重,死亡率接近100%,而毒性较低的毒株引起的临床症状较轻。非洲猪瘟起源于20世纪20年代的非洲,并于2007年传播到格鲁吉亚的高加索地区。非洲猪瘟从高加索地区逐渐传播到邻国(即亚美尼亚、阿塞拜疆、俄罗斯和白俄罗斯),在家猪和野猪群体中蔓延。自2018年8月以来,在中国检测到基因II型高毒株。辽宁、内蒙古、黑龙江等东北地区先后发生了40多起疫情,给中国养猪业造成了前所未有的损失,严重影响了国民生产和饮食结构。近年来,随着经济和国际贸易的持续增长,采取了重大措施遏制病毒的传播。了解非洲猪瘟的全球流行情况和传播途径对预防疾病暴发至关重要。基因型1也被称为ESAC-WA基因型,于1957年传播至欧洲、南美和加勒比地区。到2007年,所有国家(意大利和非洲除外)都宣布消灭非洲猪瘟。自2007年ASFV基因II型暴发以来,世界各国再次受到ASF侵袭,包括俄罗斯(2007年)、乌克兰(2012年)、波兰(2014年)、比利时(2018年)、中国(2018年)、越南(2019年)、印度(2020年)和许多其他国家。除了传播范围广之外,传播途径也非常多样。非洲猪瘟是一种通过直接或间接接触受感染的猪和粪便传播的病毒性疾病。蜱虫等生物媒介也加速了病毒的传播。机械因素如车辆、工具和人类活动,以及生猪加工产品等也是致病因素。生物安全防控是目前预防非洲猪瘟最直接、最有效的方法,优于疫苗。事实证明灭活苗对非洲猪瘟无效。一种减毒活疫苗,即越南的ASFV-G-ΔI177L,是世界上第一个商业化的ASF疫苗。然而,减毒活疫苗开发成本高、周期长、不稳定等特点限制了其快速发展。目前研究人员的重点是亚单位疫苗、载体疫苗和DNA疫苗等基因工程疫苗,而大多数实验仅限于免疫原性,没有开展攻毒实验。因此,开发安全有效的非洲猪瘟疫苗是对抗该病毒的首要任务之一。本文综述了非洲猪瘟疫苗的最新进展,强调了其优势和不足,并为取得进展提供了新的研究方向。2.非洲猪瘟的全球流行情况
非洲猪瘟最早出现于非洲,通过天然宿主和媒介进行古老的森林循环以及有或没有天然媒介参与的猪场间循环在非洲地方性传播。但是自2005年以来,已有32个国家报告了非洲猪瘟。在撒丁岛流行的基因I型仍然是地方性的,而2007年发生于格鲁吉亚的基因II型疫情却传播到邻国,包括亚美尼亚、阿塞拜疆、俄罗斯和白俄罗斯,该高毒力ASFV毒株在这些国家和地区感染了家猪和野猪。2014 - 2018年,欧洲大陆共有爱沙尼亚、立陶宛、拉脱维亚、波兰、捷克、保加利亚、比利时、罗马尼亚、匈牙利等9个国家发生非洲猪瘟严重疫情,尽管采取了控制措施,但疫情仍在持续蔓延。典型急性和亚急性感染形式的野猪中造成高病死率,特别是在新感染地区。从2020年到2022年的短短两年时间里,共有16个欧盟国家报告了这种疾病。值得注意的是,非洲猪瘟已从比利时(2020年3月)和捷克共和国(2018年4月)成功根除。2018年8月,非洲猪瘟首次在中国得到证实,并在几个月内迅速继续传播到31个省份,共发生178起非洲猪瘟疫情。2019/2020年,该病传播到大洋洲,东帝汶报告了非洲猪瘟,然后是巴布亚新几内亚,导致小规模养猪场受影响动物的高死亡率。2021年7月,非洲猪瘟在消失近40年后再次出现在美洲,首先在多米尼加共和国,然后在海地,对动物健康、牲畜市场和生产者生计构成威胁。同样,在2022年1月,意大利大陆也在大约40年后报告了ASFV基因型II的发生。与此同时,又有两个国家受到影响:北马其顿,养殖场规模小,流动率高,野猪袭击频率最高;泰国,由受感染的活猪和死猪、猪肉产品、野猪精液、受污染的饲料和污染物引起发病和传播。尼泊尔首次报告发生非洲猪瘟是在2022年3月,尽管政府已于2019年1月28日禁止从非洲猪瘟感染国家进口猪和猪肉产品。如表1所示,自2020年1月以来,已在涉及45个国家的五个不同地区报告了非洲猪瘟,影响了1,12.9万头猪和3.6万头野生野猪,造成1,931,000多头动物死亡(数据来自即时通知和后续报告)。非洲猪瘟的全球爆发导致全球生猪生产能力急剧下降,养猪业遭受重创。由于非洲猪瘟病毒感染的隐蔽性和复杂性,目前的流行情况尚不清楚。预计在3-5年内很难恢复到以前的水平。
| 爆发次数 | 发病头数 |
|
| 家猪 | 野猪 | 家猪 | 野猪 | 损失 |
| 非洲 | 201 |
| 16177 |
| 23208 |
| 美洲 | 255 |
| 9594 |
| 17798 |
| 亚洲 | 1298 | 2105 | 101482 | 2765 | 438492 |
| 欧洲 | 3703 | 20518 | 1001921 | 34159 | 1452045 |
| 大洋洲 | 4 |
| 500 |
| 397 |
| 总计 | 5461 | 22623 | 1129674 | 36924 | 1931930 |
3.非洲猪瘟的传播途径
非洲猪瘟的传播途径广泛,包括直接接触传播和间接接触传播,这使非洲猪瘟的预防和控制复杂化。野猪和蜱是非洲猪瘟的天然宿主,在通过森林循环传播中起着关键作用。无所不在的野猪群对非洲猪瘟疫区的控制和根除构成了重大障碍。在欧洲,患病和死亡的野猪是该病毒的主要来源,它们对不同的ASFV基因型,特别是基因型II分离株易感,是该疾病的直接或间接携带者。先前的研究表明,该病毒可以通过野猪-家猪途径传播,这加剧了猪和野猪之间以及同一品种群体之间的感染。在家猪循环中,家猪是该病毒的唯一宿主和携带者,病毒会长期感染,包括猪的粪便和分泌物。事实上,在几项研究中已经报告了其他也可能通过长距离机械传播成为病毒携带者的动物,如苍蝇、水蛭和鸟类,包括秃鹫。 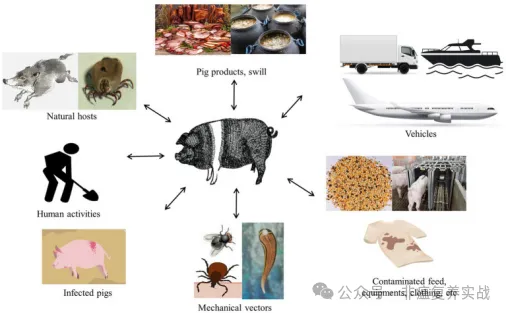
此外,人类活动促进了病毒流入猪场,加剧了病毒传播的程度。非洲猪瘟传播的一个重要途径是非法运输受感染的猪肉产品和受污染的物品,包括饲料、设备、车辆和服装。流行病学的其他关键因素,包括受污染猪肉产品的运输和猪的饲养,导致高加索地区、俄罗斯联邦和中国爆发非洲猪瘟。非洲猪瘟病毒的固有特性对温度、pH值等多种环境条件具有高度抗性,导致病毒在环境中积极存在并持续传播到遥远地区。有趣的是,几项研究已经证明,在特定条件下,非洲猪瘟病毒可以在跨大西洋航线的动物饲料中存活。此外,尽管被病毒污染的冷冻肉和加工猪肉产品不会引起人类感染,但由于病毒的长期存活,它们可能是病毒在长途运输后传播到新地区的潜在因素。4.非洲猪瘟的遗传变异
随着ASFV分型技术的不断发展,ASFV基因组遗传进化的研究进入了一个新的阶段。到目前为止,非洲猪瘟已被分为24个基因型或8个血清群。深入开展非洲猪瘟病毒基因分型研究,有助于在分子水平上追踪引起疫情的病毒起源,了解潜在的传播途径和可能的传播方式,筛选潜在的候选疫苗。 ASFV基因组是一种线性双链DNA,包括左可变区(LVR)、中心保守区(C区)和右可变区。不同毒株的基因组序列可能存在显著的位置差异,如LVR内的多基因家族(MGF)、CVR内的中心变量区(CVR)、C区EP402R基因(表达CD2v蛋白)等。这些不同的区域为非洲猪瘟病毒的进化分析,特别是遗传进化分析提供了有利条件。1957年,基因I型病毒首次在非洲以外的葡萄牙被发现并引发疫情。从那时起至90年代在葡萄牙,西班牙,古巴,巴西和其他国家流行。作为亚洲地区报告的首例病例,基因I型毒株于2021年首次在中国临床样本中检测到。目前,基因I型病毒在一些西非国家仍占主导地位,而北非未报告疫情。在中非,基因1型和基因2型同时占主导地位。ASFV具体应变信息见表2。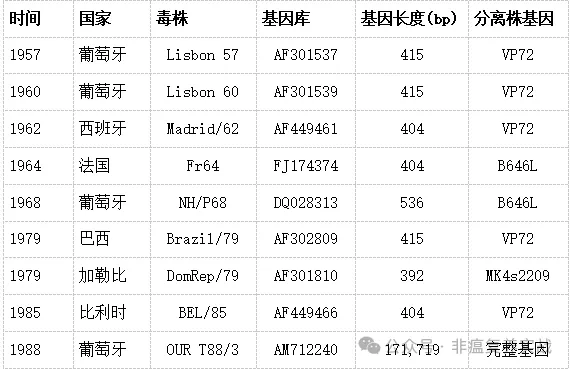
表2 非洲猪瘟特定毒株信息(来源:国家生物技术信息中心)Portugal等人对ASFV高毒力毒株Lisboa60 (L60)和低毒力毒株NH/P68 (NHV)的基因组进行了测序,并将其与其他已知毒力毒株的差异分数进行了比较。分析表明,L60和NHV与来自欧洲和西非的p72基因型1型ASFV毒株相关,支持了欧洲毒株起源于西非的假设。由于L60和NHV之间的间隔时间长,地理距离远,这表明二者早就在葡萄牙广泛传播。自2007年格鲁吉亚传入基因II型ASFV以来,世界都卷入对抗基因II型流行病的战争。ASFV基因型1株与目前流行的基因型2株有很大不同。从山东和河南养殖场的猪临床标本中分离到2株ASFV基因I型SD/DY-I/21和HeN/ZZ-P1/21,两株ASFV无猪红细胞吸附活性。全基因组分析表明,这两株毒株与20世纪在葡萄牙分离的基因I型低毒株NH/P68和OURT88/3高度相似,与早期在欧洲和非洲分离的基因I型高毒株L60和Benin 97有显著差异。SD/DY-I/21和HeN/ZZ-P1/21毒株尽管具有较高的全基因组序列相似性,但在某些基因上存在显著差异,提示它们可能属于不同的入侵源。基因I型和基因II型毒株在中国的共存说明了当前防控形势更加严峻,须加快疫苗的研制进程。随着基因克隆、PCR和测序技术的快速发展,非洲猪瘟基因组学研究取得了令人满意的进展。p72基因分型是目前广泛用于ASFV基因分型的金标准。Gonzague等人证实,1999年分离的马达加斯加ASFV毒株与1994年分离的莫桑比克ASFV毒株有99.2%的相关性,其p72基因片段高度保守。2003年,Bastos等人首次利用p72蛋白的c末端序列将非洲猪瘟病毒分为10个基因型。2005年,Lubisi等人进一步将非洲猪瘟病毒分为16个基因型。2007年,Boshoff等人对来自南非的43株ASFV(1973-1999)分离株进行了研究。2016年,Achenbach等人对埃塞俄比亚分离的非洲猪瘟病毒(2011-2014年)进行了比较分析,再次确定了一种基因型。2017年,Quembo等人对从莫桑比克戈龙戈萨国家森林公园采集的软蜱样本中分离出的19株ASFV进行了分析。一项进化树特异性分析显示,5个毒株属于一个新的进化分支。至此,共鉴定出24种ASFV基因型。为了提高我们对相似毒株进化趋势的理解,Gallardo等人发现整个ASFV基因组在I73R和I329L基因的基因间区(IGR)具有不同的串联重复序列(TRS)组合。例如,波兰和立陶宛ASFV分离株的IGR与白俄罗斯和乌克兰分离株相同,但与俄罗斯分离株不同,这表明波兰和立陶宛的ASFV流行株可能起源于白俄罗斯。后来发现俄罗斯IGR位点的病毒株自2012年以来发生了变化,推测欧盟的ASFV流行株可能起源于俄罗斯。2019年,该毒株(中国/广西/2019)在IGR位点有两个串联重复序列,主要在中国发现,被命名为IGR- III型。随后,该病毒株也相继在韩国和越南出现。在波兰也发现了一种具有三个串联重复序列(即IGR-IV)的病毒株。2020年,德国ASFV大流行毒株3 '末端的DNA聚合酶PolX基因O174L可被区分为5个不同的谱系,至少有10个不同的突变,这表明突变导致了改变基因的致病作用。同年,印度尼西亚兽医科学研究中心从西爪哇省茂物区养猪场采集了样本。非洲猪瘟阳性率为16/19,基因组分析显示该基因型与越南、中国和俄罗斯家猪的基因型相同。Senthilkumar等人首次揭示了印度毒株的基因组分析,该毒株与亚洲地方性毒株有远亲关系。可能有助于识别亚洲特有毒株的一个重要特征是I73R和I329L基因之间的不匹配。2021年沙巴州的ASFV基因分型显示,该毒株与中国、越南和印度尼西亚的地方性毒株相似。因此,今后应加强全基因组水平的ASFV基因组监测,这有利于掌握ASFV的流行格局,研究疾病演变,筛选理想的候选疫苗。
膜消安---由月桂酸酸单甘油酯(GML)胶束纳米颗粒(10%)、高效干扰素诱生剂组成,专业杀灭囊膜病毒,用于蓝耳、流行性腹泻、非洲猪瘟、流感等病毒性疾病预防和治疗,也用于饮水和饲料中病原的净化及发病时带猪消毒。
GML不溶于水,固体形式的GML吸收率很低,需添加到2%以上才有一定的抗菌抗病毒效果。膜消安采取特殊工艺把GML做成胶束纳米颗粒水溶液,含量高达10%,即使稀释2000倍以后含量仍能达到50mg/L(GML临界胶束浓度为16mg/L),所以稀释后仍然能形成稳定的胶束纳米颗粒,非常容易被机体吸收并发挥抗菌抗病毒作用。


